干货分享 | pull-down(下拉实验)详细解析
2024-08-19 来自: 长沙东晟生物技术有限公司 浏览次数:2076
接上篇,本篇小编为大家介绍一下pull-down实验,又称“下拉实验”,是一种体外亲和纯化技术,用于考察蛋白之间的互作关系。
pull-down(下拉实验)的原理
pull-down实验,即下拉实验,也称为体外蛋白结合实验,用以确定已知蛋白和未知蛋白间的互作关系。通过将已知蛋白作为诱饵蛋白,用生物素-、PolyHis-或GST-等标签对其进行标记,然后将诱饵蛋白固定在与其亲和的固相支持物上充当诱饵,与蛋白样品或细胞/组织裂解液共孵育,可捕获样品中与诱饵蛋白互作的蛋白,接着通过洗涤或洗脱过程去除其余物质,并将捕获的蛋白回收,进行WB或质谱等检测分析。目前pull-down中应用是广泛的融合标签是GST(g l u t a t h i o n e-S-transferase,谷 胱 甘 肽-S-转移酶)。
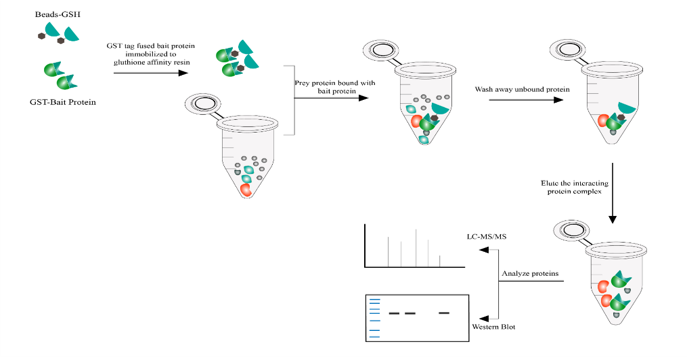
pull-down(下拉实验)的目的
1.互作蛋白的识别:鉴定特定蛋白质的互作伙伴,揭示蛋白质相互作用网络,有助于理解细胞信号传递和调控的机制。
2.功能分析:通过确定互作蛋白,可以推断目标蛋白的功能和调控途径。例如,某个蛋白质的互作伙伴可能是其底物、调控因子或抑制剂。
3.蛋白质复合物的研究:pull down实验可用于研究蛋白质复合物的组成和结构。通过确定复合物成员及其相互作用方式,可以深入了解复杂的蛋白质互作网络。
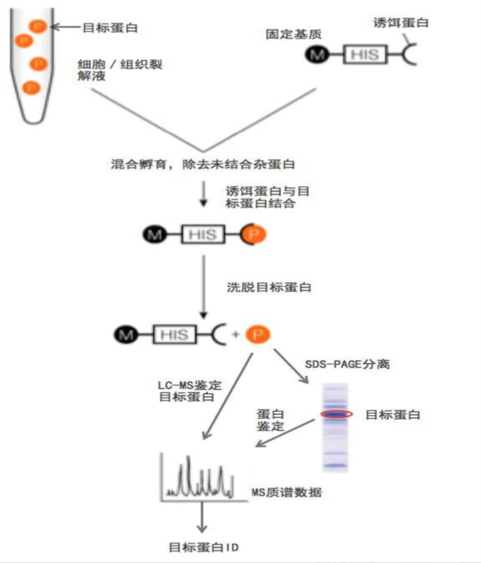
pull-down(下拉实验)的分类
GST pull down是常用的蛋白与蛋白互作实验方法,利用重组技术将探针蛋白与GST谷胱苷肽巯基转移酶融合,融合蛋白通过GST与固相化在球珠上的GSH谷胱甘肽结合,从而分离出能与融合蛋白相互作用的蛋白。
DNA pull-down技术是一种用于研究蛋白质与DNA之间相互作用的实验方法。其原理基于蛋白质与特定DNA序列之间的亲和性,通过特定的DNA探针捕获与其结合的蛋白质,从而实现对蛋白质-DNA复合物的富集和分析。
RNA pull-down实验是将RNA进行生物素探针标记,捕获与其结合的蛋白质,从而实现对蛋白质-DNA复合物的富集和分析。目前RNA pull-down技术已成为研究miRNA、lncRNA与相互作用蛋白的主要技术手段之一。
RNA-RNA pull-down是检测RNA与其靶RNA之间相互作用的主要实验手段之一。RNA-RNA pull-down使用体外转录法标记生物素RNA探针,捕获与其结合的RNA,通过qRT-PCR实验检测特定的RNA是否与靶标RNA相互作用。
IP和pull-down的区别

实验问题:Input中无条带,但IP中有
可能原因:Input中无条带但IP中有可能是目的蛋白丰度低,WB的一抗不够灵敏,而经IP富集后可检测到;洗脱条件不适宜。
解决方案:第一种情况可以选择灵敏度更高的抗体,或通过外源性过表达来提高目的蛋白的丰度;可使用多种洗脱缓冲液进行比较,找到最合适的洗脱条件。一般可分为变性洗脱和非变性洗脱。变性洗脱是用SDS-PAGE上样缓冲液使蛋白变性,可有效解离抗原-抗体的亲和作用,方便后续做WB检测。如果后续需要进行功能性分析,则需要使用非变性的酸性洗脱法(0.1M甘氨酸,pH2.5-3),可解离大多数抗原-抗体互作的同时保留目的蛋白的活性。
相反Input中有条带,而IP中没有
可能原因:可能是IP所用的抗体是识别蛋白内部的线性表位,而不是构象表位,导致无法捕获目的蛋白。
解决方案:在兼顾抗体特异性的同时,选择适用于IP的抗体是关键。
GST pull-down实验结果含有大量背景信号和减少GST pull-down中的假阳性结果如何解决?
背景信号可能来自于非特异性结合。可以尝试增加洗脱步骤次数、使用更严格的洗脱条件,或添加非特异性结合抑制剂如BSA。
假阳性结果主要是由于自发形成的聚集态,非特异的吸附和其他非特异性相互作用引起的。为了减少GST pull-down中的假阳性结果,通过添加更多的非离子型洗涤剂和用特定的pH缓冲液来消除这些非特异性的互作,同时在检测前应该用0.1%的Tween-20(或其他洗涤剂)处理GST-beads。
IP和pull down都能检测互作,那Co-IP能验证到互作,为什么GST pull-down却验证不到?
Co-IP是体内实验,可能检测到基于其他蛋白作为桥梁的间接互作,而GST pull-down证明的是两个蛋白的直接相互作用,如果中间桥梁缺失,则不会呈现互作状态。





 在线客服
在线客服
