国自然热点-蛋白质翻译后修饰(糖基化修饰)
2024-10-16 来自: 长沙东晟生物技术有限公司 浏览次数:88
一、糖基化概述
1.研究趋势

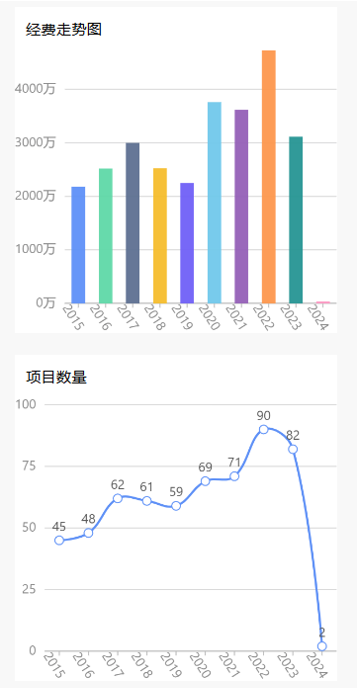
2.糖基化中标题目
cMyBP-c糖基化修饰增强PPARa活性促进心肌细胞脂肪酸摄取引起脂毒性心肌病的作用及机制研究
类型:地区科学 基全项目 批准年份:2024
RIPK1 的O-GlcNAc糖基化在炎性衰老中的机制和功能研究
类型:面上项目 批准年份:2024
基于“酸性收敛”研究乌梅丸通过杯状细胞内质网Ern2促进MUC2蛋白O-糖基化修饰治疗溃疡性结肠炎的作用机制
类型:面上项目 批准年份:2023
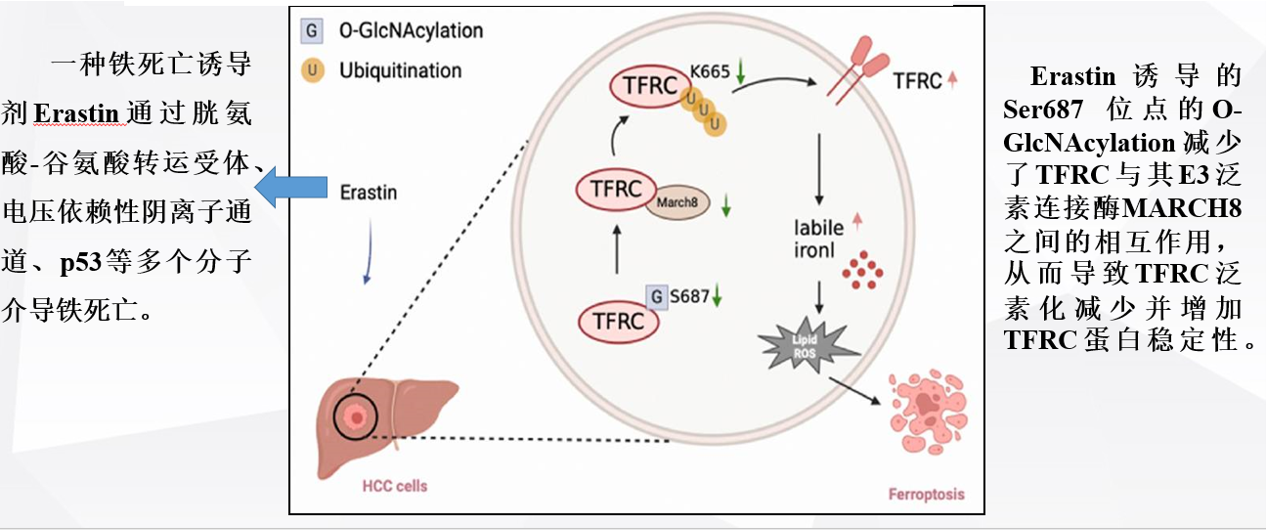
转铁蛋白糖基化调控Hippo/YAP通路促进肾小管上皮细胞铁死亡对糖尿病肾病的影响和机制研究
类型:地区科学基金项目 批准年份:2023
HTR2B糖基化调控ARRB1介导的线粒体糖代谢重编程在主动脉瓣膜钙化中的效应及机制
类型:青年科学基金项目 批准年份:2023
3.糖基化修饰定义
糖基化是一种常见的翻译后修饰,是细胞内二级蛋白加工的一种精细调节机制,影响蛋白构象、溶解度、活性、稳定性、电荷、药代动力学、蛋白酶抗性和对其他蛋白质的亲和力。
蛋白质糖基化是糖基转移到由糖基转移酶催化的蛋白质的过程,主要发生在内质网和高尔基体中。主要过程是将糖基在糖基转移酶作用下将糖链转移至蛋白质,和蛋白质上的氨基酸残基形成糖苷键,经过一系列转运、糖链末端的剪切,修饰和岩藻糖化或者唾液酸化等完成糖基化蛋白质的组装大多数聚糖存在于细胞表面和分泌蛋白中,具有错综复杂和多样的结构。
4.糖基化修饰类型
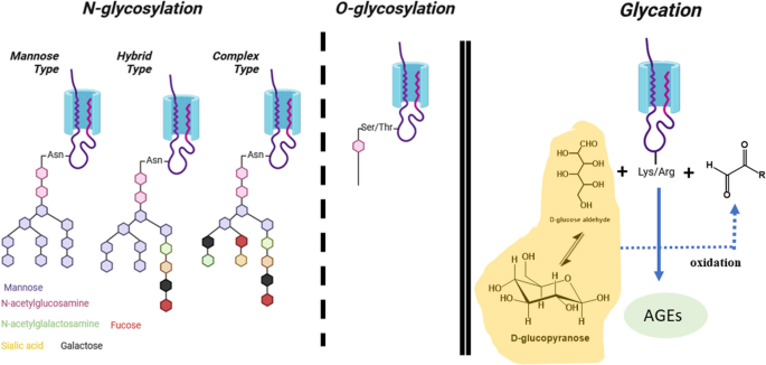
根据糖链附着的位置和方式,糖基化可分为N-连接糖基化和O-连接糖基化
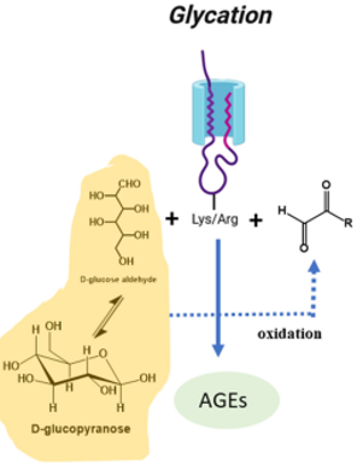
糖化(Glycation)是一个自发性、非酶环节,它将游离糖共价结合到蛋白质中。
N-连接多糖的核心结构由由两个 N-乙酰氨基葡萄糖 (GlcNAc) 和一个支链甘露糖(α-1,3 和 α-1,6)组成的复合五糖组成,该五糖与另外两个甘露糖单元结合。
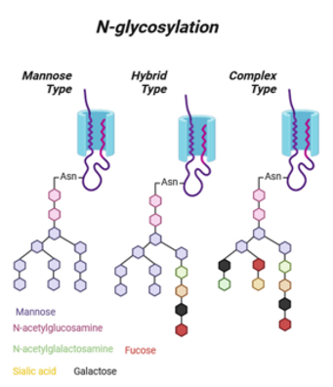
五糖与两个甘露糖单元结合之后,可连接各种类型不同数量的的糖分子(即岩藻糖、甘露糖、GlcNAc、唾液酸等),具有三种常见模式:
(i)高甘露糖类型(以下所有单位都是甘露糖);
(ii)复杂类型(一组非均质的碳水化合物部分);
(iii)杂交型(一种甘露糖与多甘露糖链结合,另一种与一组异质碳水化合物部分结合)。
O-糖链的单糖组成通常较为简单,但连接方式和亚型繁多,因此结构较为复杂。
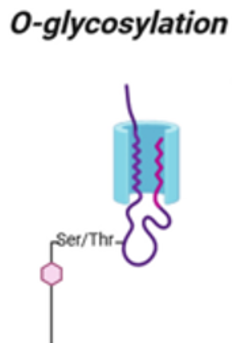
O-糖基化不涉及脂质连接的寡糖前体,以转移到新生的多肽上。相反,它包括Ser或Thr残基与GalNAc、Man、Glc、Xyl或Fuc之间形成的单个糖苷键。
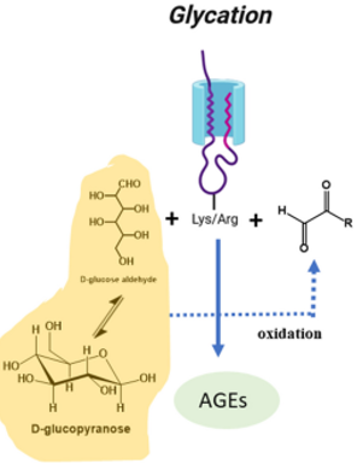
5.糖基化作用


6.糖基化预测
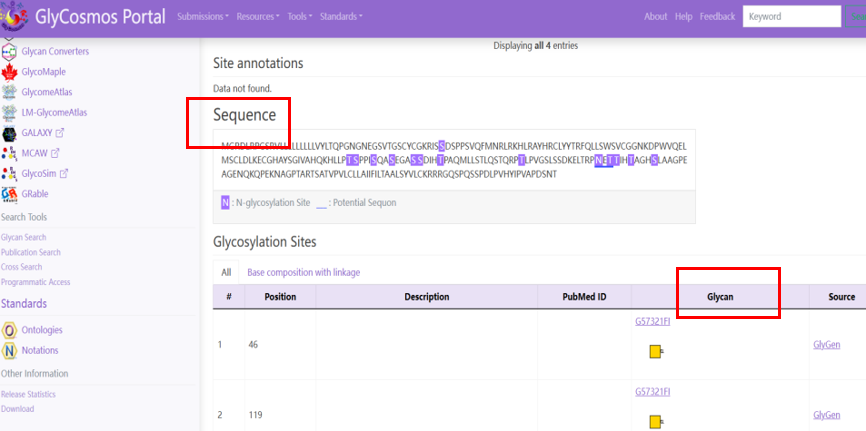

二、糖基化检测
糖基化检测方法
质谱分析(Mass Spectrometry, MS):定量分析糖基化水平的变化。
免疫印迹分析(Western Blot):通过使用特异性抗体,可以检测特定蛋白质的糖基化水平。糖基化修饰通常会影响蛋白质的分子量,因此在电泳中可以观察到迁移率的变化。
凝集素(Lectin)亲和层析:通过凝集素亲和层析可以富集特定类型的糖基化蛋白,然后进行进一步分析,如质谱。
HPLC(高 效液相色谱):结合荧光或质谱检测,可以实现糖链的定量和定性分析。
流式细胞术(Flow Cytometry):如果目标蛋白表达在细胞表面,可以使用流式细胞术结合糖基化特异性抗体来检测细胞表面蛋白的糖基化状态。
三、设计思路






 在线客服
在线客服
