国自然热点-蛋白质翻译后修饰(泛素化修饰)
2024-10-17 来自: 长沙东晟生物技术有限公司 浏览次数:88
一、泛素化概述
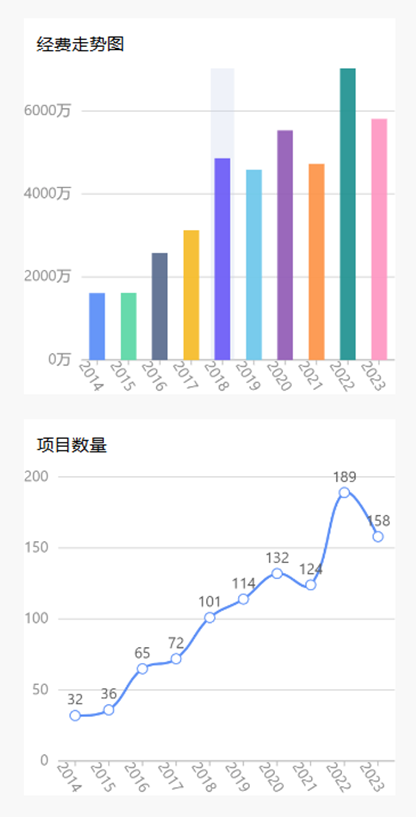
1.泛素化研究趋势

2.泛素化中标题目
ABRO1调控HIF-1α去泛素化导致CCR2+/MerTK+巨噬细胞稳态失衡抑制心肌梗死后修复的机制研究
类型:面上项目 批准年份:2023
USP12去泛素化修饰Mst1抑制线粒体自噬促进心肌缺血再灌注损伤的机制研究
类型:地区科学基金项目 批准年份:2023
CHTOP调控去泛素化酶USP21介导气道上皮细胞铁死亡参与香烟烟雾所致COPD发病的机制研究
类型:青年科学基金项目 批准年份:2023
能量应激诱导的circZFR抑制可变剪切调控蛋白HNRNPLL泛素化促进肺腺癌代谢重编程的机制研究
类型:重 点项目 批准年份:2022
3.泛素
泛素(ubiquitin, Ub)是一种由 76 个氨基酸组成的分子量约8.5 kDa 的小分子蛋白质, 它的主要功能是标记需要分解掉的蛋白质,使其被26S 蛋白酶降解。
人类基因组中的四个基因编码泛素:
UBB,UBC,UBA52、RPS27A
泛素氨基酸序列:
MQIFVKTLTGKTITLEVEPS
DTIENVKAKIQDKEGIPPDQ
QRLIFAGKQLEDGRTLSDYN
IQKESTLHLVLRLRGG
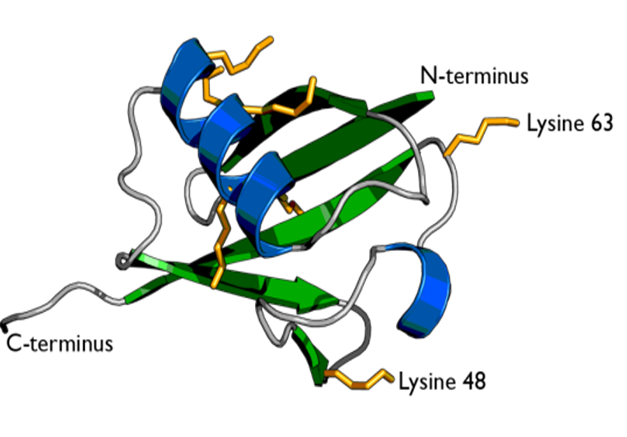
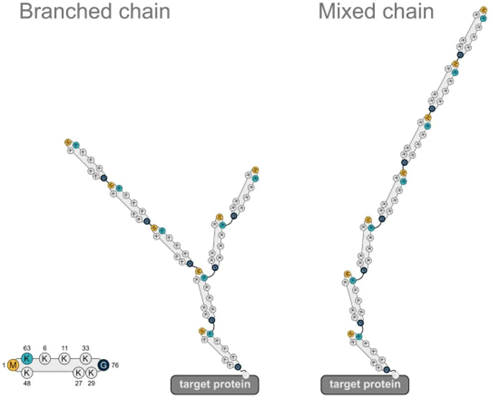
泛素具有7个赖氨酸残基(K6,K11,K27,K29,K33,K48,K63)和一个甲硫氨酸残基(M1)。泛素之间主要通过赖氨酸残基和甲硫氨酸残基进行各种连接。由此产生的泛素链产生一定的拓扑结构,可通过对蛋白底物进行修饰并决定底物的功能。
4. 泛素化
泛素化是指泛素在一系列酶的催化作用下共价结合到靶蛋白的过程。泛素化修饰还可以直接影响蛋白质的活性和定位,调控包括细胞周期、细胞凋亡、转录调控、DNA 损伤修复以及免疫应答等在内的多种细胞活动。
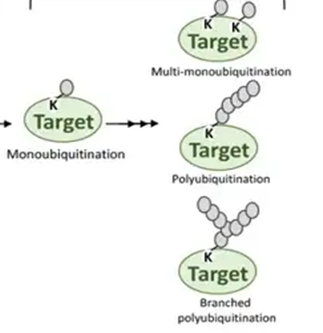
泛素可结合的底物残基有赖氨酸、丝氨酸、半胱氨酸、酪氨酸
结合方式:单泛素化、多泛素化、多聚泛素化
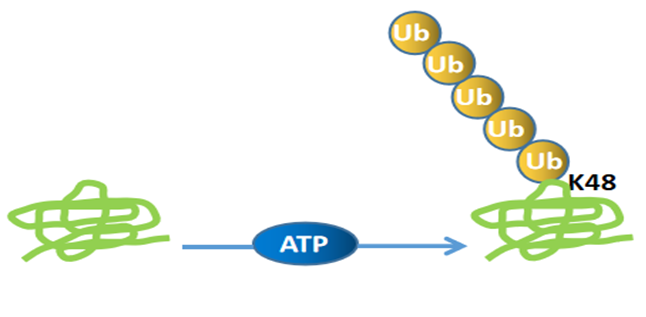
根据泛素与底物的连接位点,目前有9种方式的泛素化,包括M1, K6,K11,K27,K29,K33,K48,K63, G76。不同方式的泛素化调控不同的功能。其中,与蛋白酶体降解相关的泛素化为K48。K48连接是所有泛素链中最为常见的,约占所有连接的50%。
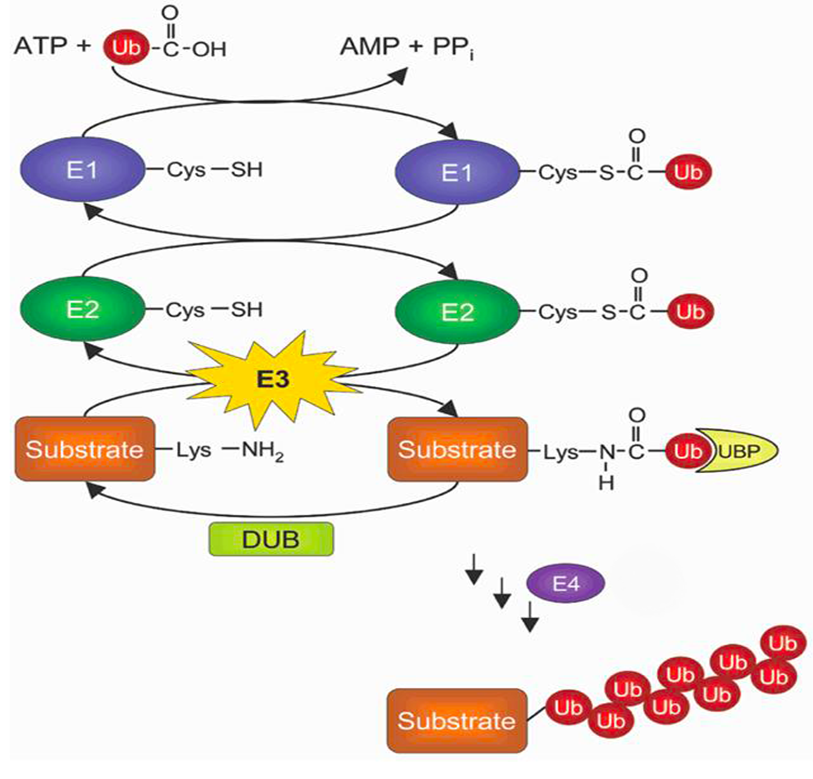
4.泛素化修饰过程
①E1类酶激活泛素,该过程需要ATP(三磷酸腺苷)提供一定能量;
②泛素激活酶E1将活化的泛素分子传递给E2类酶;
③泛素连接酶E3将结合E2的泛素连接到靶蛋白上;
④被标记的蛋白质分子尾端形成一小段泛素分子链;
⑤26s蛋白酶体特异性地识别这个带有泛素标签的底物蛋白,将其降解掉。
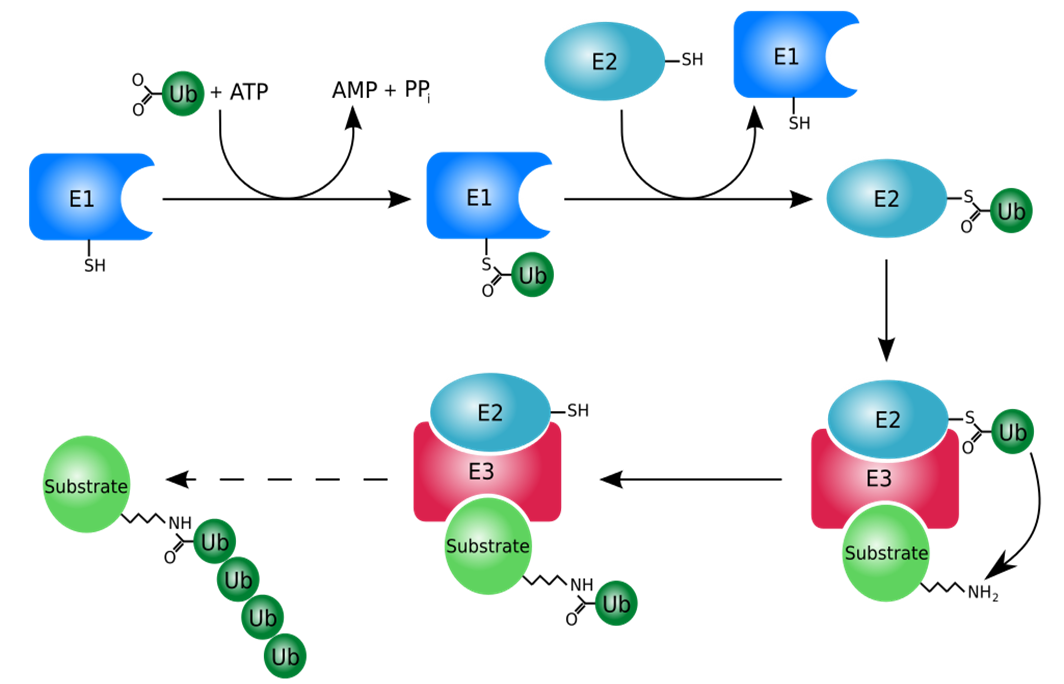
总的来说,靶蛋白是在泛素激活酶E1、泛素结合酶E2、泛素连接酶E3的依次作用下共价连接上几个泛素分子,最后被26s蛋白酶体特异性地识别并降解成小肽,泛素在去泛素连接酶的作用下进行回收利用,这些小肽再被细胞质中的蛋白酶降解为氨基酸。
5.泛素系统的组成

人体内还存在E4酶。E4酶为泛素链延伸因子,能够对单泛素化的底物进行泛素链的延伸形成多聚泛素化。
6.泛素化预测

http://ubibrowser.bio-it.cn/ubibrowser_v3/
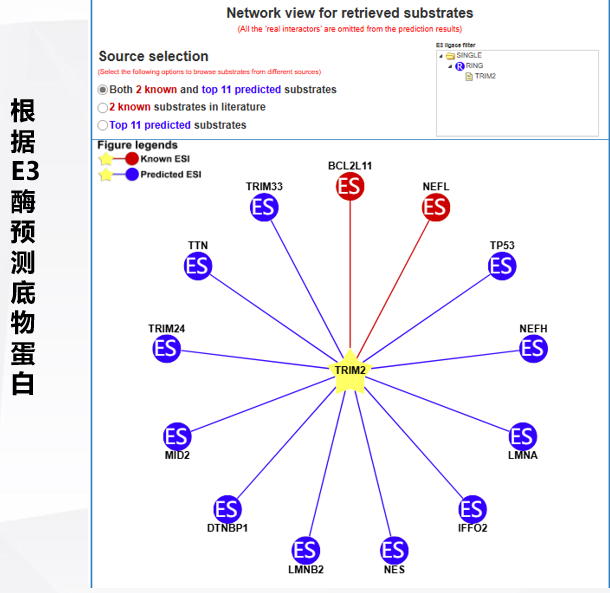
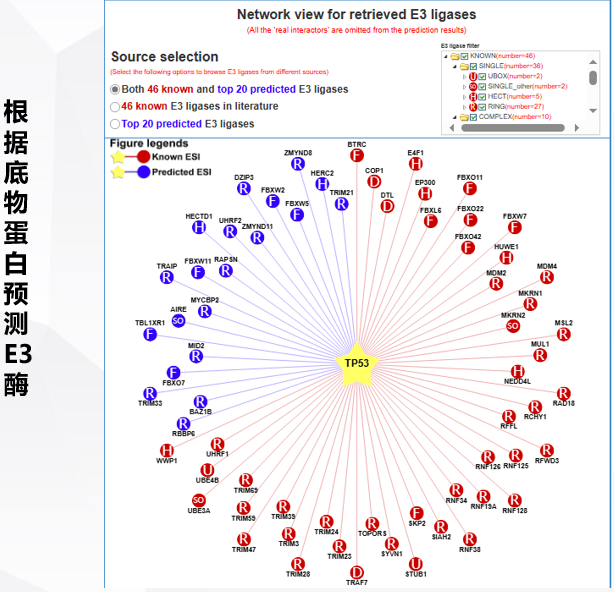
二、泛素化检测
泛素化检测方法
免疫印迹法:使用抗泛素抗体或者通过使用针对特定底物的抗体来识别,检测特定蛋白的泛素化状态,并评估泛素化的程度。
免疫共沉淀(Co-IP):通过免疫共沉淀方法将某一特定蛋白以及与其结合的蛋白分离出来。分离出来的蛋白再进行SDS电泳和western blot分析。这一方法可以明确具体哪个蛋白的哪个赖氨酸残基发生了泛素化修饰。
质谱分析(MS):对泛素化蛋白进行质谱分析,可以高通量地识别和定量泛素化位点及其修饰状态。
荧光标记技术:通过转染带有荧光标签的泛素或目标蛋白,实时观察细胞内泛素化过程。
小分子抑制剂:使用泛素化途径的抑制剂(如蛋白酶体抑制剂)观察泛素化对细胞功能的影响。
体外泛素标记突变位点实验:将要研究的蛋白(被泛素化的蛋白),提取内源性蛋白或者通过基因工程技术重组表达后提纯。
三、设计思路
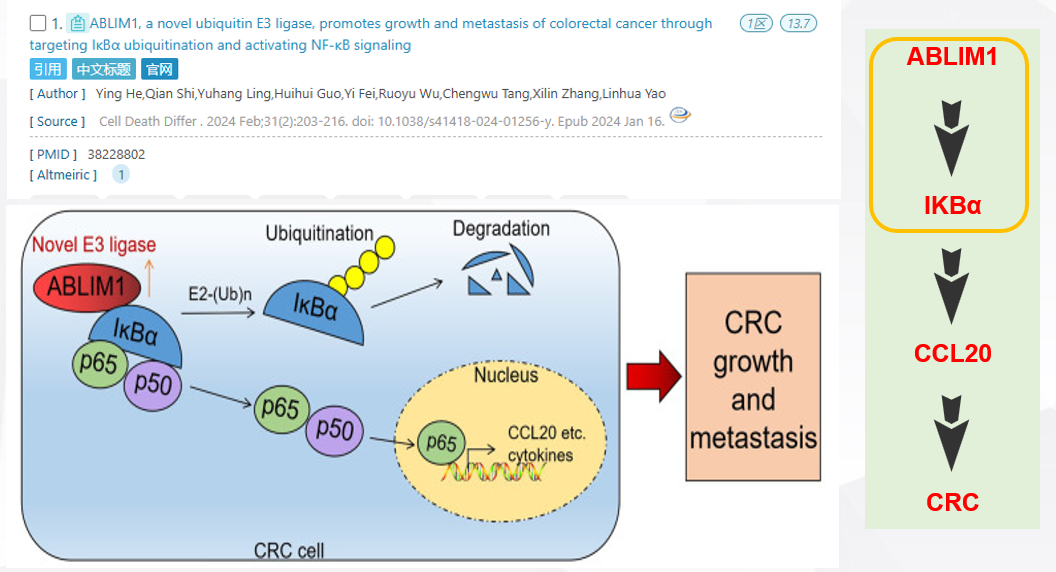
ABLIM1 是一种新型泛素 E3 连接酶,通过靶向 IĸBα 泛素化和激活 NF-ĸB 信号传导促进结直肠癌的生长和转移。





 在线客服
在线客服
