流式细胞术(细胞凋亡、细胞周期)实验操作
2024-09-24 来自: 长沙东晟生物技术有限公司 浏览次数:86
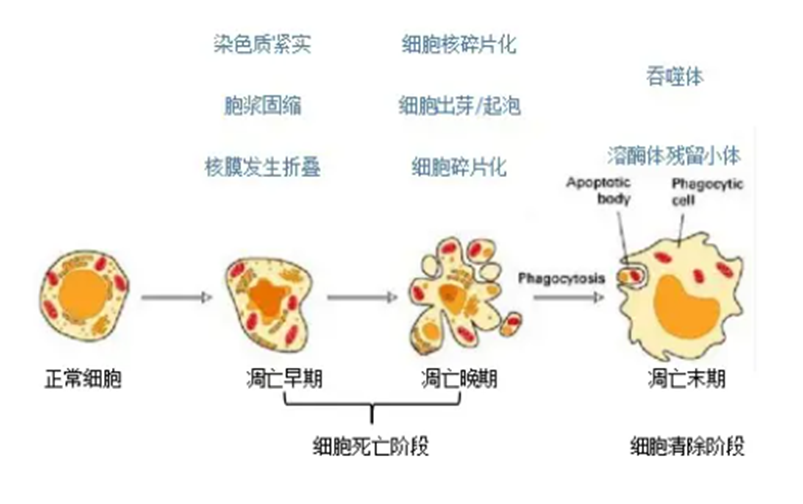
细胞凋亡(apoptosis)指为维持内环境稳定,由基因控制的细胞自主的有序的死亡。与细胞坏死不同,细胞凋亡不是一件被动的过程,而是主动过程,它涉及一系列基因的激活、表达以及调控等的作用,是为更好地适应生存环境而主动争取的一种死亡过程。
试剂盒
细胞凋亡是发生在胚胎发育和维持组织稳态过程中的正常生理过程,伴随着许多形态学特征改变,其中细胞膜的丢失是细胞凋亡早期的特征之一。
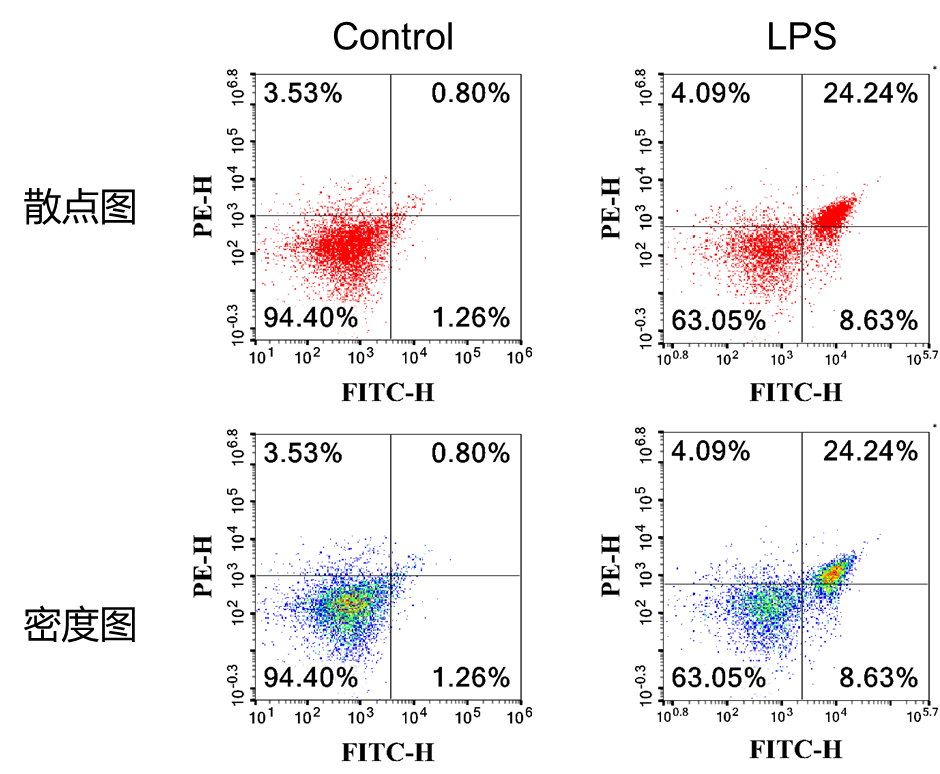
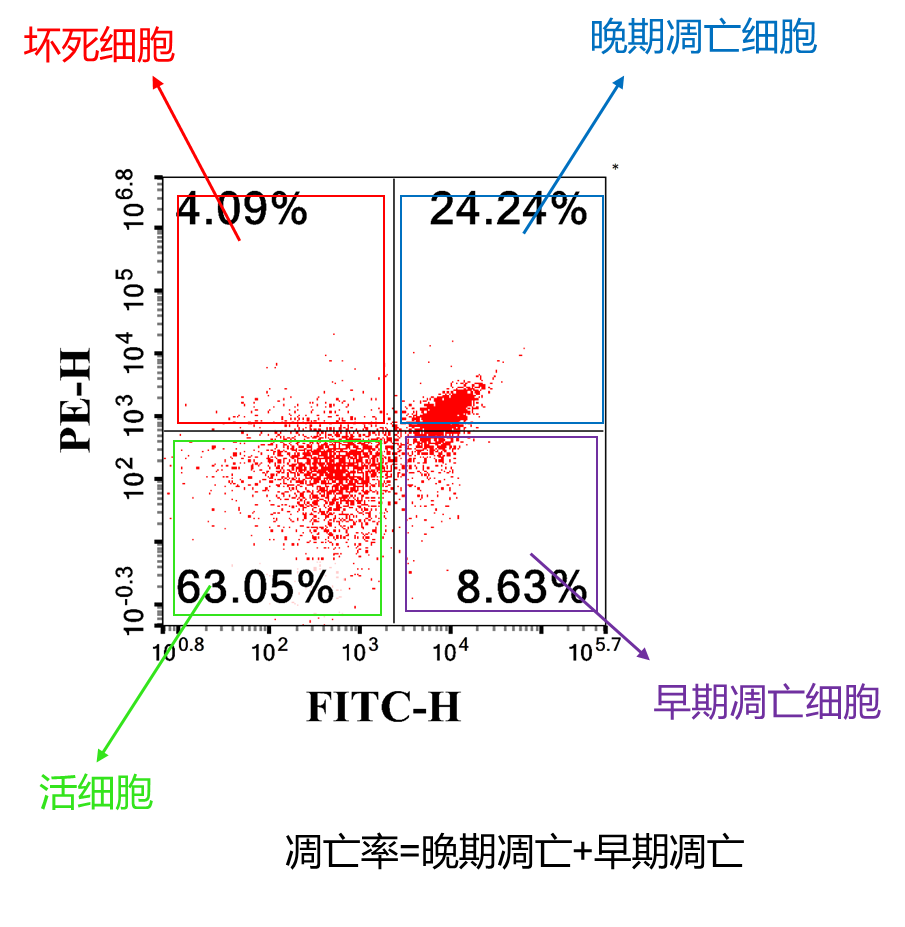
在正常细胞中,磷脂酰丝氨酸(phosphotidylserine,PS)只分布在细胞膜磷脂双分子层的内侧,但在细胞凋亡早期,PS会从脂膜的内侧翻转外侧,使其暴露于细胞外侧。Annexin V(膜联蛋白 V)是一种Ca2+依赖的磷脂结合蛋白,对 PS 具有高度亲和力,会与暴露PS的细胞特异性结合,因此 Annexin V 被作为检测细胞早期凋亡的指标之一。
碘化丙啶(Propidium Iodide,PI)是一种核酸染料,它不能透过具有完整细胞膜的正常细胞和早期凋亡细胞,但能透过凋亡晚期和坏死细胞的细胞膜并将细胞核染色。
操作步骤
1、悬浮细胞:取细胞悬液,经 500 g,4℃离心 5 min 收集细胞;
贴壁细胞:先收集细胞培养上清液。然后用不含 EDTA 的胰 酶消化后,与细胞培养上清液合并,经 500 g,4℃离心 5 min 收集细胞。胰 酶消化时间不宜过长,以免过度消化引起假阳性。
2、用预冷的 PBS清洗细胞 2 次,每次 500 g、4℃离心 5 min 收集细胞;
3、用预冷的 1×Binding Buffer 轻柔重悬细胞,调整细胞浓度至 1~5×10 6/mL;
4、取 100 μL 细胞悬液,加入 5 µL Annexin V-FITC 和 5 µL PI,轻柔混匀,室温避光 8-10 min;
5、加入 400 µL 预冷的 1×Binding Buffer,轻轻摇匀,1 h 内用流式细胞仪或者荧光显微镜进行检测。
注意事项
整个实验过程操作应尽量轻柔避免细胞破碎,影响实验结果。
用 PBS 清洗细胞不可省略,同时也要尽可能的去掉残留的 PBS。
使用胰 酶消化细胞时,应小心操作,避免人为损伤细胞,并控制消化时间。消化时间过短,细胞需用力吹打才能脱落,容易造成细胞膜的机械损伤;若消化时间过长,细胞膜同样容易受到损伤。影响检测结果。另外不能使用含 EDTA 的胰 酶,EDTA 会影响Annexin V 与PS的结合。
贴壁细胞经凋亡刺激后,如有部分细胞漂浮,需同时收集细胞培养上清液及贴壁细胞合并染色,会使得结果更加准确。
Annexin V-FITC 和 PI 对光敏感,操作时注意避光。反应结束后应尽快进行检测。
实验过程中请穿实验服并戴一次性手套,避免污染,确保安全。
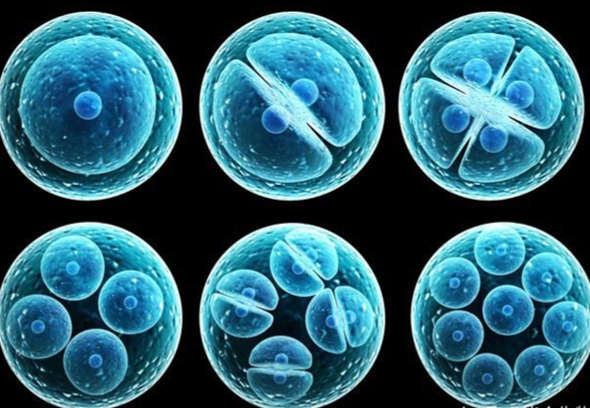
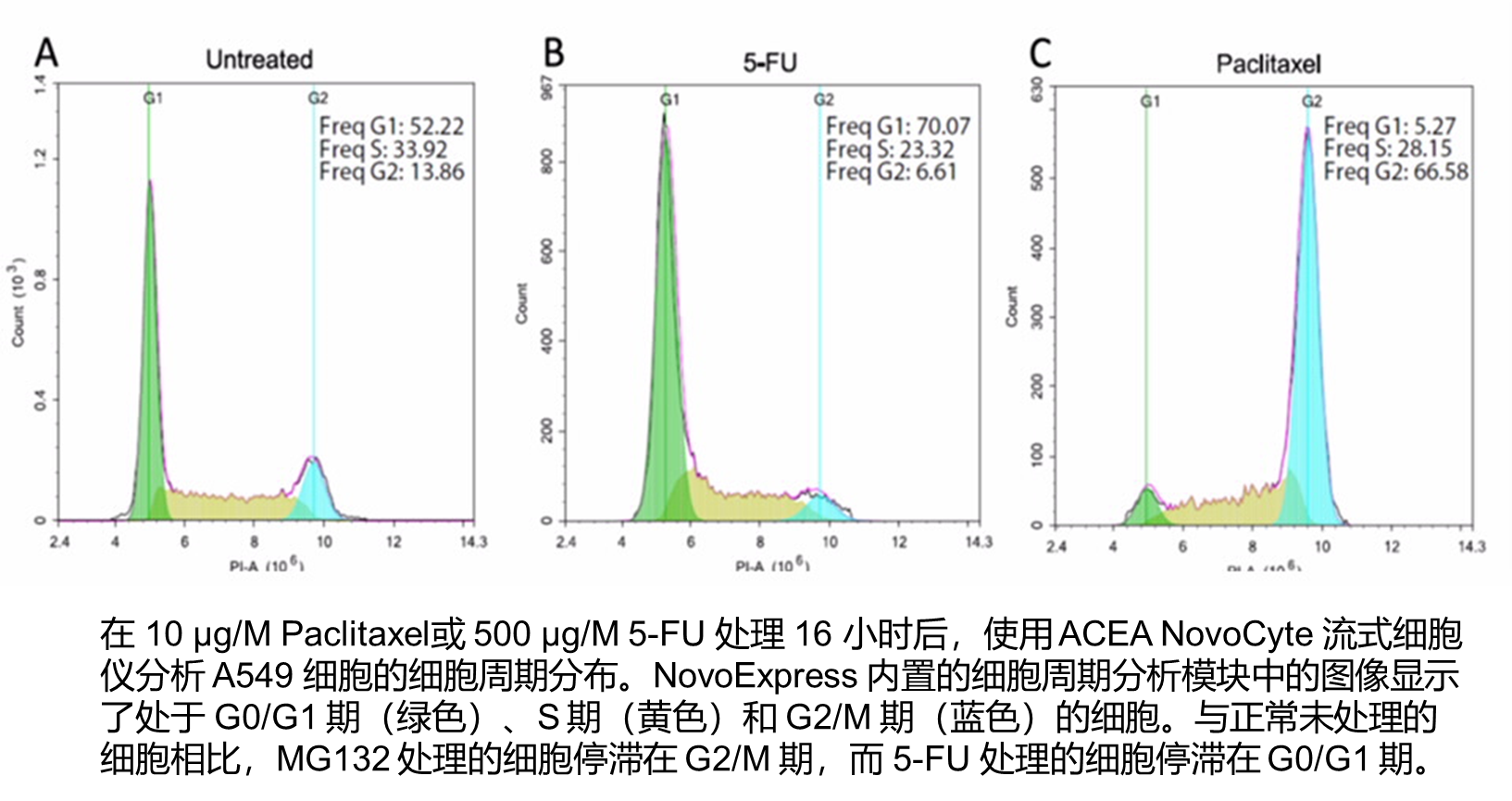
细胞周期是基于细胞处于不同分裂时期具有不同的DNA含量而分析细胞处于不同的时期的方法。
细胞周期是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,主要分为细胞分裂间期与有丝分裂期(M期)两个阶段;细胞间期主要由DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期)组成,整个细胞周期变化顺序可用G1→S→G2→M来表示。
G1期:细胞主要合成RNA和蛋白质等物质,为细胞进入S期做好物质和能量的准备;
S期:细胞开始进行DNA和一些组蛋白等物质合成,细胞DNA含量开始增加;
G2期:这时细胞DNA含量已经变成了G1时期的2倍,并已经停止了DNA的复制,为进入有丝分裂期做大量的蛋白质等物质的合成;
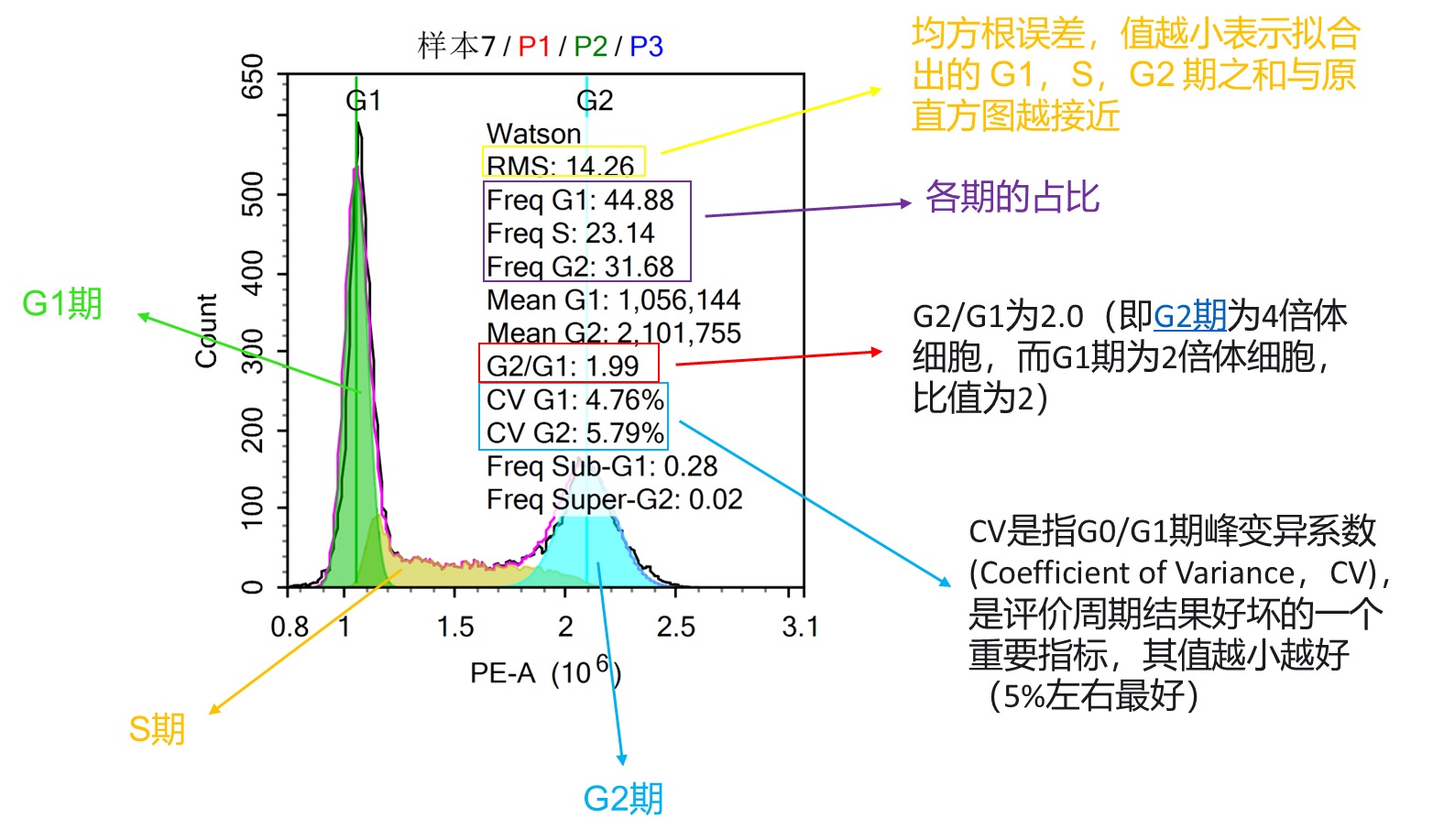
如果G0(细胞暂时停止分裂和分化期、静止期)/G1期,细胞中DNA含量为1N;那么处于G2期的细胞中 量为2N;而处于G1和G2时期之间的S期细胞,DNA含量在1N~2N之间;因此,可根据细胞DNA的含量来判断细胞所处的周期和状态。
细胞周期与凋亡检测试剂盒(CellCycle and Apoptosis Analysis Kit)采用了经典的碘化丙啶染色(Propidiumstaining)方法对细胞周期与凋亡进行检测分析。利用碘化丙啶能够嵌入双链 DNA 中,并使其产生荧光,并且荧光强度和双链 DNA的含量成正比的特性;结合细胞不同周期中,DNA 含量的规则变化,可以区分细胞处于的周期和状态。
实验步骤
实验准备: 1. 含血清的细胞培养基; 2. 胰蛋白酶消化液; 3. PBS 缓冲液; 4. 75%乙醇。 1. 细胞样品准备(细胞数量控制在 1×10*5~1 ×10*6个) 1.1. 对于贴壁细胞:去除培养液,加入胰蛋白酶消化液消化细胞,在显微镜下观察到细胞变圆松动,加入适量含血清的细胞培养基终止消化,轻轻吹散细胞,将细胞制成悬液;将悬液转移至离心管中,1000 g离心 3-5 min,弃上清,保留细胞沉淀;再用预冷PBS缓冲液润洗 1-2 次细胞沉淀,同样方法离心弃上清,保留细胞沉淀。 1.2. 对于悬浮细胞:直接将细胞转移至离心管中,1000 g离心 3-5 min,弃上清,保留细胞沉淀;再用预冷PBS缓冲液润洗 1-2 次细胞沉淀,同样方法离心弃上清,保留细胞沉淀。 2. 细胞样品固定 2.1. 向收集的细胞沉淀样品中加入 1 mL冰上预冷的 75%乙醇,轻轻吹打细胞,使其充分接触; 2.2. 将细胞置于 4℃固定 30 min或更长时间(通常固定 2 h或以上更能保证染色效果,固定 12-24 h可能效果更佳,可提高染色效果)。 2.3. 固定一定时间后,将细胞 1000 g离心 3-5 min,去除乙醇固定液,保留细胞沉淀; 2.4. 轻敲离心管底部,使细胞分散,用PBS缓冲液重悬并洗涤细胞,1000 g离心 3-5 min,弃上清收集细胞沉淀。 3 . 染色工作液的配制与染色 3.1. 根据下表避光配制染色工作液,配制量可以根据使用需求,等比例增加或减少(配制完成的染色工作液短时间内可以 4℃保存,请当日内使用); 3.2. 轻敲离心管底部,使步骤 2.4 中沉淀的细胞分散,再加入 500 μL 配制好的染色工作液,轻轻吹打,使细胞分散并与染色工作液混匀; 3.3. 37℃避光孵育 30 min,即可用流式细胞仪进行检测。 4. 流式检测和分析 用流式细胞仪在激发波长 488 nm 波长处检测红色荧光,同时检测光散射情况。采用适当分析软件进行细胞 DNA 含量分析和光散射分析。 注意事项 荧光染料均存在荧光淬灭问题,使用和保存过程中尽量避光。 在实验前建议对细胞进行周期同步化处理,避免细胞所处周期不同导致的较大重复性差异。 实验细胞种植密度不宜过高也不宜过低,以防出现接触抑制或密度依赖等现象。 操作PI染色液时应注意防护,避免直接接触人体或吸入体内。 操作时请穿实验服,佩戴一次性手套。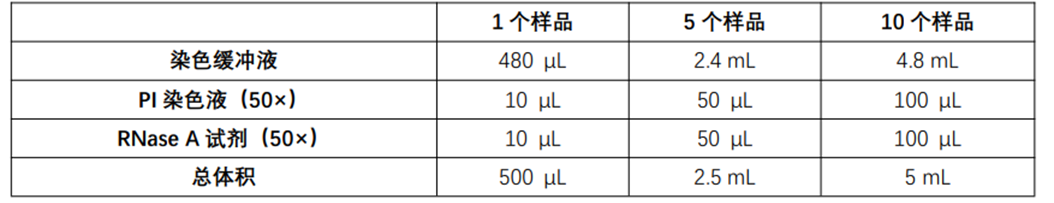





 在线客服
在线客服
